La suite logicielle Ennov Regulatory
Avoir une solution bout-en-bout centralisée et unifiée, qui soit suffisamment robuste pour supporter différents flux de gestion de l’information, des premières étapes de R&D jusqu’à l’obtention de l’autorisation de commercialisation, est un principe commun partagé par les compagnies qui s’efforcent d’atteindre l’excellence opérationnelle réglementaire. Ces entreprises ont également compris qu’utiliser une telle solution les aidera à harmoniser leurs processus, encourager la standardisation, améliorer la collaboration, assurer la conformité, éliminer les pertes de temps, diminuer les coûts, accélérer la commercialisation de leurs produits et être plus concurrentielles sur les marchés internationaux.
La suite Ennov Regulatory combine la puissance et la flexibilité d’Ennov Doc, Ennov Dossier et Ennov Process pour couvrir l’intégralité du cycle de vie des produits réglementés, des premières phases de planification des enregistrements prévisionnels jusqu’à leur retrait de la vente. La suite Ennov Regulatory est un outil précieux pour la planification des activités réglementaires, la gestion des enregistrements produits, la création et la gestion de dossiers d’AMM et bien plus.
Avantages
- Unique source de vérité : Gérez et suivez l’ensemble de vos communications, processus et données réglementaires dans une unique solution pour rationaliser vos activités et garantir la conformité réglementaire.
- Meilleures performances : Éliminez le papier et la saisie manuelle de vos processus. Automatisez les tâches répétitives et sources d’erreur pour de formidables gains de productivité.
- Connectivité globale : Encouragez la collaboration au-delà des départements et des frontières géographiques grâce à une solution commune unifiée disposant d’une interface utilisateur intuitive et localisable.
- Meilleure visibilité : Obtenez des informations précieuses sur vos activités pour identifier et prévenir les tendances problématiques avant qu’elles ne conduisent à des problèmes qualité.
Doc pour le réglementaire
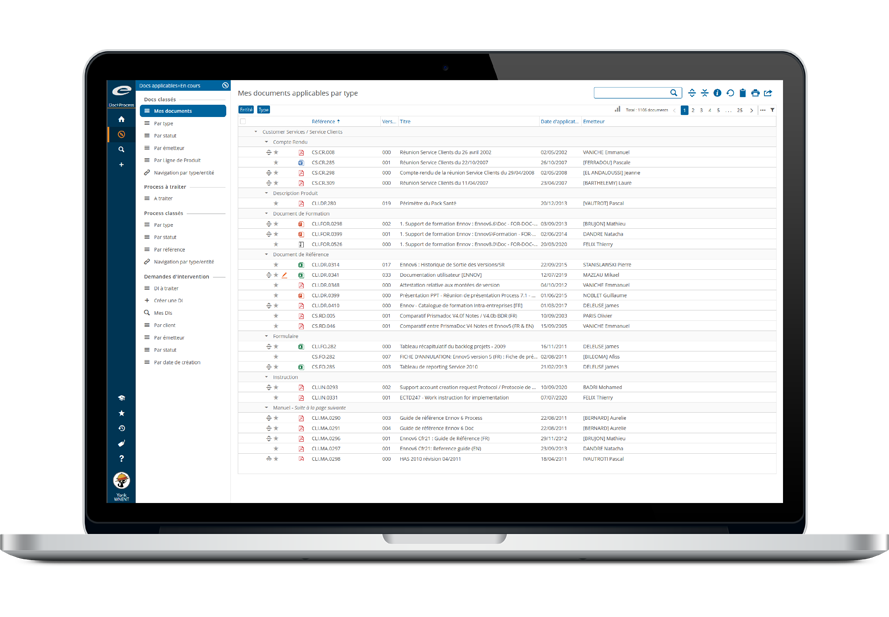
La gestion de la documentation administrative, des CMC, des documents cliniques et non cliniques devient efficace avec Ennov Doc.
Les processus fragmentés de création, d’organisation et de partage de documents dans le cadre de vos soumissions réglementaires peuvent être pénibles. Utiliser des e-mails, des feuilles de calcul ou des partages de fichier aux arborescences complexes et incohérentes entre elles pour gérer les actifs les plus importants de votre entreprise est inefficace, sujet à erreur et risqué. Notre solution de GED et de soumission de dossiers d’AMM rationalise vos opérations réglementaires, garantit la conformité et réduit les délais de commercialisation.
Grâce à son panel complet de fonctionnalités combiné à une excellente ergonomie utilisateur, Ennov Doc bénéficie de taux d’adoption très élevés, pour un retour sur investissement plus rapide.
Dossier
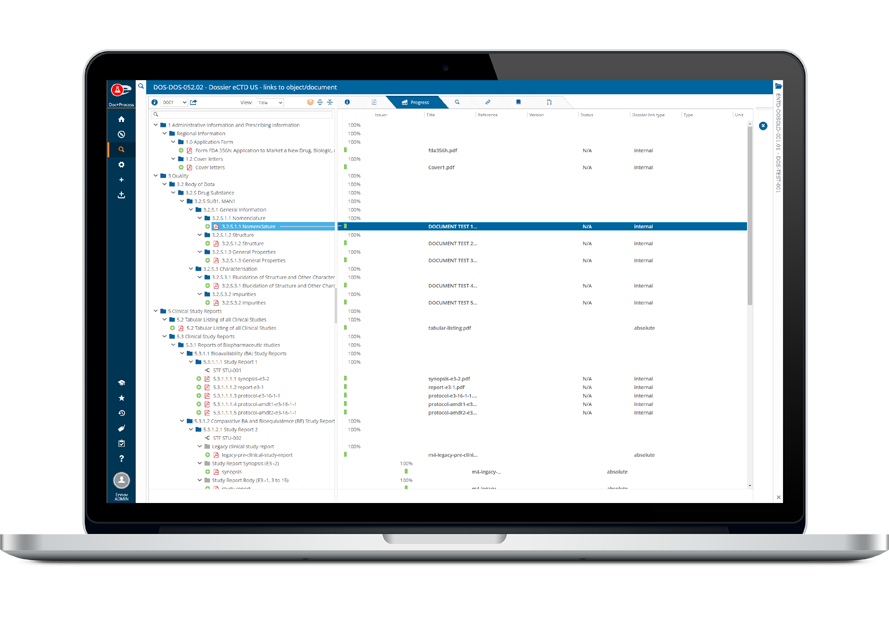
Accélérez les approbations avec notre logiciel de soumission intuitif et conforme
Ennov Dossier supporte la création de soumissions réglementaires électroniques (eCTD, NeeS, VNeeS, eCopy) et papier via une interface commune unifiée. Solution full web, Ennov Dossier est idéale pour les déploiements multisites ou internationaux. Il intègre des outils d’assemblage de dossiers d’AMM faciles d’utilisation, avec des commandes spécialement conçues pour la capture et la gestion des métadonnées eCTD. Pour un maximum de rapidité et de simplicité, les documents stockés dans Ennov Doc ou tout répertoire WebDav peuvent être facilement glissées-déposées dans l’assembleur de dossier. Directement fournis pour les régions acceptant des soumissions eCTD, les templates d’assemblage de dossiers d’AMM sont également modifiables pour répondre à vos besoins spécifiques. Ennov Dossier est une solution de création de dossiers d’AMM complète et évolutive, qui convient aux essais cliniques de toute taille et génère un document conforme à toutes les exigences des agences réglementaires.
RIM
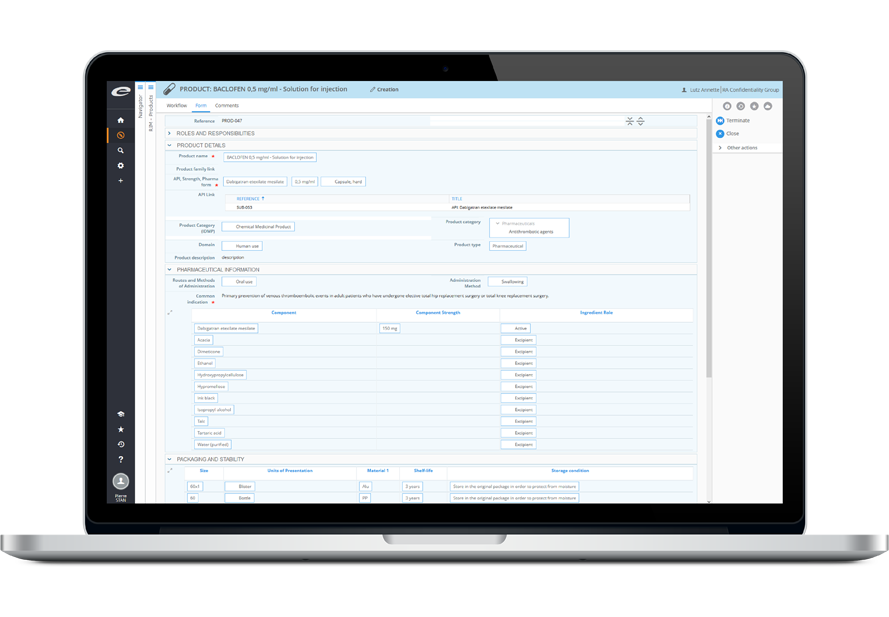
Avec notre puissante solution RIM, prenez en main vos informations et enregistrements produits, vos soumissions et vos activités réglementaires
Dans les entreprises internationales, la gestion des informations réglementaires est rarement intégrée et consiste généralement en un assemblage hétéroclite de feuilles de calcul, de bases de données artisanales, d’e-mails et de rapports ad hoc – contenant chacun des données redondantes et / ou incohérentes. Toutefois, à mesure que les enregistrements produit se complexifient et que les volumes de données augmentent, les entreprises réalisent qu’il est crucial, pour des activités efficaces qui garantissent la conformité à l’échelle de l’entreprise, de pouvoir répondre aux questions portant sur tout aspect de leurs activités réglementaires de façon efficiente et dans les délais. Ennov RIM est une application dédiée (basée sur Ennov Process) à la gestion et au suivi des informations sur les médicaments et dispositifs médicaux, et des informations d’enregistrement. Que vous planifiez le lancement d’un nouveau produit ou que vous gériez des variations d’enregistrements existants, Ennov RIM vous donne les informations et les fonctionnalités clés pour gérer efficacement votre portfolio de produits à l’international.
IDMP
Avec Ennov IDMP, préparez votre organisation pour les nouveaux standard ISO
Les standards ISO IDMP (“Identification of Medicinal Products”) sont un ensemble de standards internationaux communs pour les éléments, les formats et la terminologie des données, utilisé pour identifier et échanger des informations ayant trait aux médicaments. L’introduction et la mise en œuvre progressive de ces nouveaux standards IDMP signifient que les organisations devront capturer et gérer significativement plus de données réglementaires qu’auparavant, ce qui représente un challenge significatif pour l’industrie dans son ensemble. Ennov IDMP est une solution de gestion des données faisant l’objet d’un contrôle qualité, pour la prise en charge des nouveaux standards IDMP.

 Suite Ennov Regulatory
Suite Ennov Regulatory