Suite Ennov Regulatory
RIM
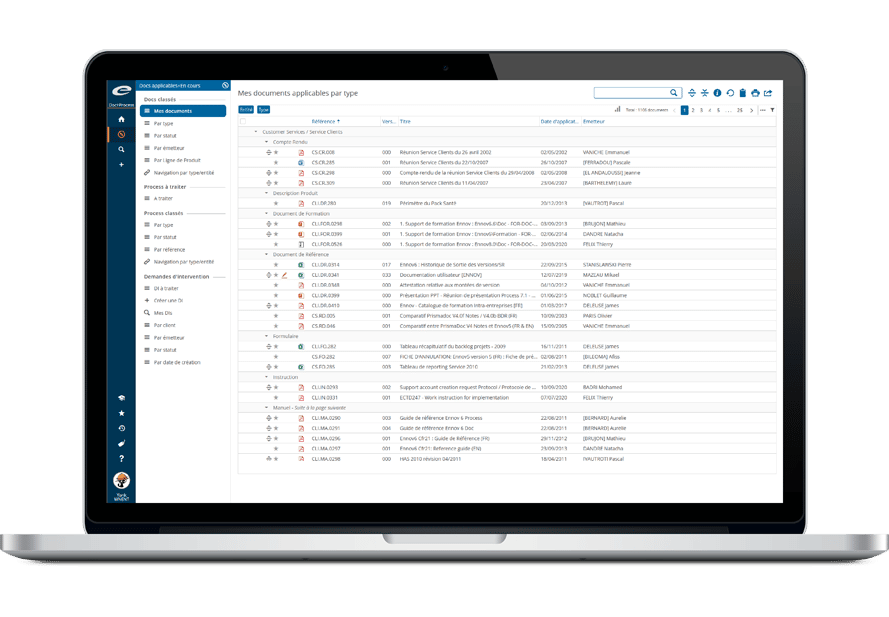
Logiciel de gestion des informations réglementaires
- Solution RIM complète
- Intrinsèquement connectée à Ennov Doc et Ennov Dossier
- Entièrement configurable pour prendre en charge l’intégralité de votre référentiel produit
- Piloté par processus
- Fonctionnalités avancées de requêtes, de reporting et de visualisation des données
La gestion des informations réglementaires : un véritable défi
Le paysage réglementaire international devient de plus en plus complexe. Aux États-Unis, la moitié des approbations de NDA (New Drug Application) émises par la FDA est assortie d’un engagement à effectuer des essais cliniques supplémentaires. Dans l’Union Européenne, la complexité des soumissions régionales continue d’augmenter. Et, bien que les marchés émergeants représentent des opportunités de croissance, les exigences de soumission vagues des autorités sanitaires locales peuvent rendre les obtentions d’autorisation de commercialisation relativement imprévisibles. L’ensemble de ces facteurs souligne le besoin de fonctionnalités de gestion des informations réglementaires avancées.
Dans les entreprises internationales, la gestion des informations réglementaires est rarement intégrée et consiste généralement en un assemblage hétéroclite de feuilles de calcul, de bases de données artisanales, d’e-mails et de rapports ad hoc – contenant chacun·e des données redondantes et / ou incohérentes.
Toutefois, à mesure que les enregistrements produit se complexifient et que les volumes de données augmentent, les entreprises réalisent qu’il est crucial, pour des activités efficaces qui garantissent la conformité à l’échelle de l’entreprise, de pouvoir répondre aux questions critiques pour l’entreprise portant sur tout aspect de leurs activités réglementaires, de façon efficiente et dans les délai.
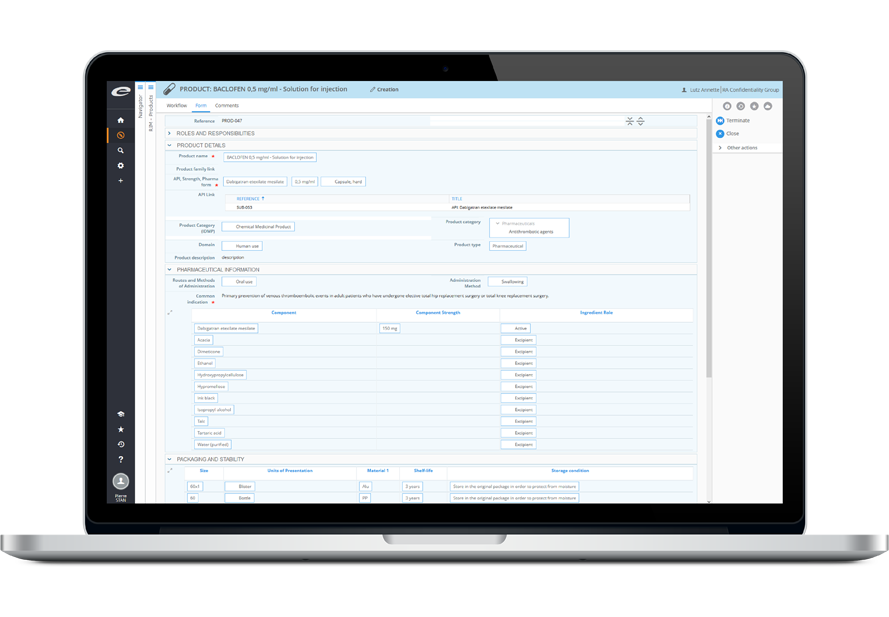
Ennov RIM : votre unique source de vérité pour les informations réglementaires
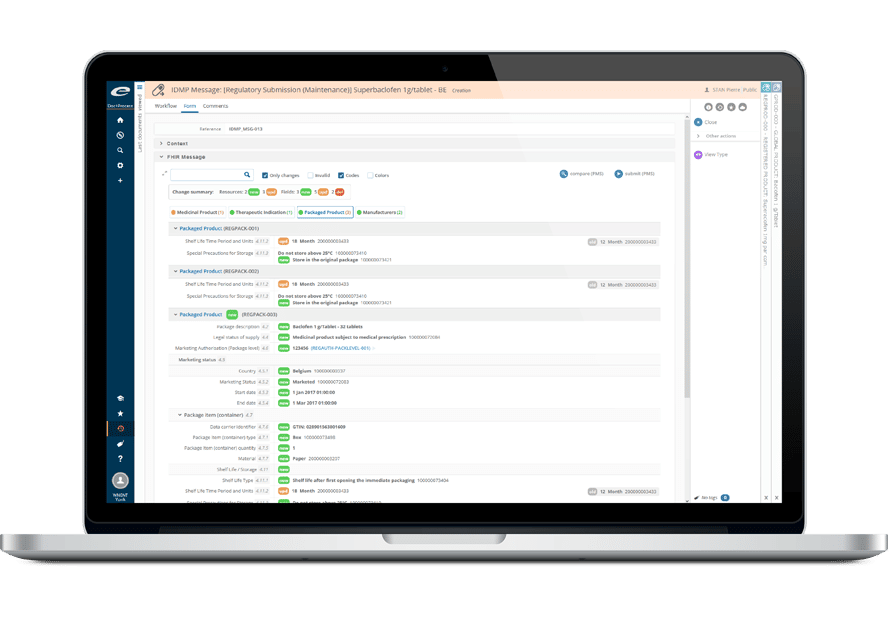
Imaginez : l’ensemble de vos informations réglementaires sur les produits, les enregistrements, les soumissions, les correspondances, les engagements, accessible partout, dans un unique espace centralisé ! Avec Ennov RIM, rationalisez vos processus réglementaires, améliorez la qualité de leurs données, répondez rapidement aux questions critiques pour l’entreprise, et réagissez efficacement aux demandes des autorités sanitaires.
Ennov RIM est une application dédiée (basée sur Ennov Process) à la gestion et au suivi des informations des produits médicinaux et des informations d’enregistrement. Que vous planifiez le lancement d’un nouveau produit ou que vous gériez des variations d’enregistrements existants, Ennov RIM vous donne les informations et les fonctionnalités clés pour gérer efficacement votre portfolio de produits à l’international.
Dotée d’une interface utilisateur intuitive et configurable, servie par des notifications e-mail, la solution full web propose des fonctionnalités de gestion des tâches réglementaires, de correspondance et de suivi des engagements. La fonctionnalité de planification des activités réglementaires proposée par Ennov RIM permet de gérer la soumission de projets couvrant plusieurs applications. L’information est saisie une fois, et répliquée au besoin sur différents produits, pays et applications.
Une meilleure efficacité opérationnelle
Avec Ennov RIM, transformez vos données en actions ! Solution pilotée par processus, Ennov RIM identifie clairement ce qui doit être fait, quand et par qui. Ses fonctionnalités avancées de workflow garantissent la visibilité des tâches et des échéances, grâce à des mises à jour de statut en temps réel et des notifications automatiques par e-mail. Des fonctionnalités avancées de requête et un reporting visuel via tableau de bord fournissent une visibilité complète de toutes les activités menées au sein des affaires réglementaires.
Ennov RIM permet de gérer efficacement l’intégralité de votre référentiel produit, y compris les thérapies de petites et grandes molécules, les dispositifs médicaux, les combinaisons médicament-dispositif médical, les produits alimentaires / les suppléments et bien plus. Notre solution complète mais flexible vous apportera l’assurance que vos enregistrements restent à jour, et que tous vos produits restent sur le marché.
Des tableaux de bord innovants pour le planning, l'analyse et les métriques d'impact
Les tableaux de bord d’Ennov RIM sont conçus pour tous les professionnels utilisant les fonctionnalités RIM. Les affaires réglementaires peuvent visualiser la charge de travail prévue et comprendre instantanément les activités à venir ou en retard. Les professionnels de la qualité peuvent réaliser des analyses d’impact pour visualiser les enregistrements impactés par un changement de fabricant, de substance active ou d’excipient donné. Le management peut visualiser les informations ayant trait au respect des délais et au volume des activités réglementaires.
Des tableaux de bord plug-and-play couvrent l’ensemble du spectre des activités réglementaires, y compris les soumissions, les correspondances et les engagements, et fournissent analyses spécialisées des PSUR, analyses d’impact et bien plus.
Fonctionnalités principales
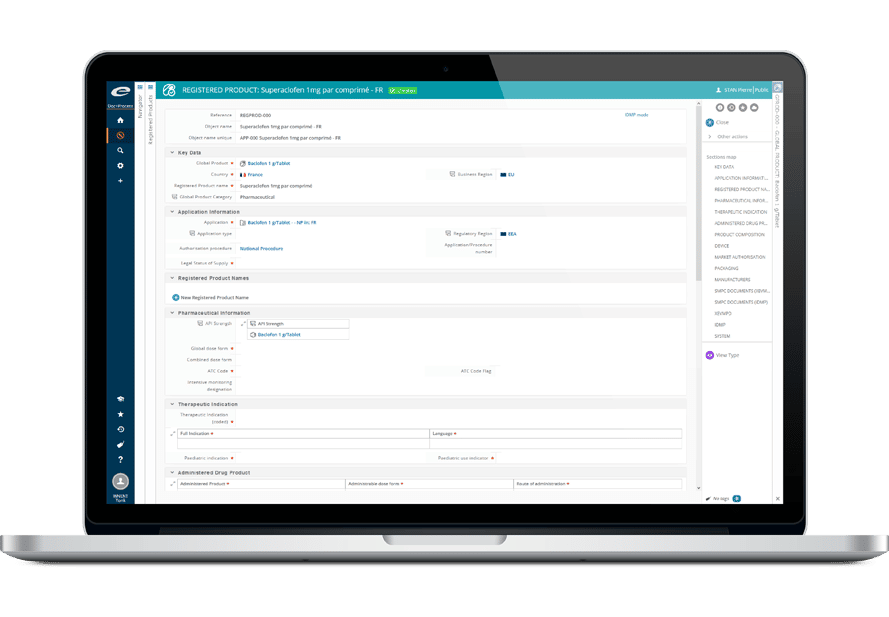
- Gestion centralisée des informations produit détaillées
- Gestion des autorisations de commercialisation et des enregistrements
- Planification et suivi des activités réglementaires et de soumission
- Lien automatique entre les substances, les produits, les enregistrements, les activités, les dossiers, les soumissions et les documents.
- Suivi des correspondances et des engagements
Fonctionnalités clés
- Gestion des droits d'accès par rôle
- Modèle de données configurable
- Notifications automatiques par e-mail
- Interface utilisateur intuitive
- Puissant moteur de workflows
- Conforme 21 CFR Partie 11
Ennov Regulatory
Gestion de l’information et du contenu réglementaire de classe mondiale
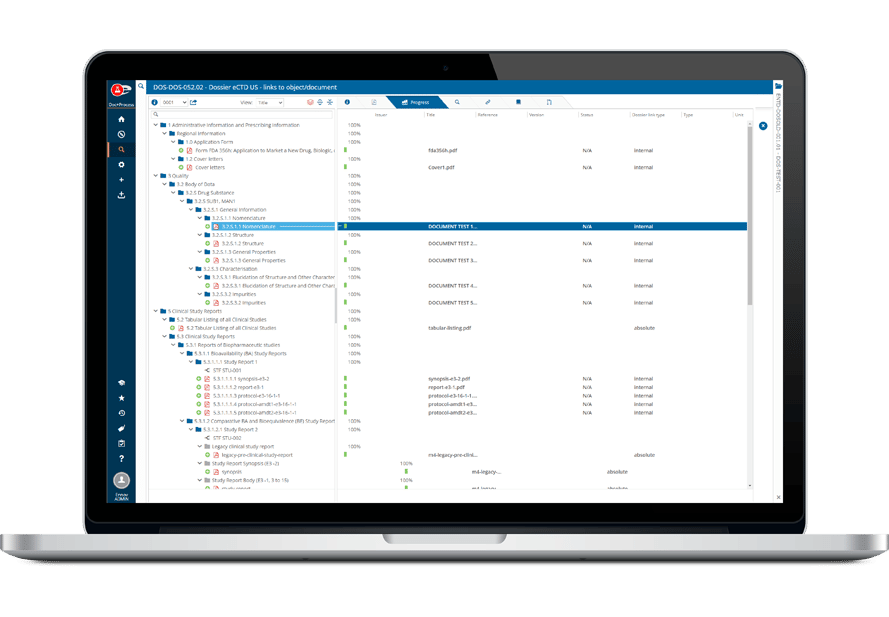
La suite Ennov Regulatory combine la puissance et la flexibilité d’Ennov Doc, Ennov Dossier et Ennov Process pour prendre en charge l’ensemble du cycle de vie réglementaire des produits, depuis la planification des objectifs d’enregistrement jusqu’au retrait du produit. La suite Ennov Regulatory est un outil précieux pour la planification des activités réglementaires, la gestion des enregistrements de produits, la création de dossiers, la gestion des dossiers et plus encore.
Pourquoi choisir Ennov ?
Des centaines de professionnels nous font confiance
20+ années d'expérience des solutions réglementaires
250+ clients dans les sciences de la vie, bien d'autres dans d'autres secteurs.
Architecture et interface modernes
100% web. Hautement évolutives. Design centré sur l'utilisateur.
Notre engagement pour votre succès
Satisfaction client très élevée. 98.5% des projets livrés dans le respect des délais et du budget.
Nous respectons votre liberté de choix
Disponible en cloud ou sur site mises deployment
Basculez à tout moment entre les deux modes.
Nous vous rendons autonomes
Ni la configuration ni la gestion du système ne nécessitent de compétences informatiques.
Sécurité améliorée et performances optimisées
Les données sont stockées localement pour une flexibilité totale. Cette architecture single-tenant minimise les interruptions.

Cloud-based or On Premises

Multi-Platform