Suite Ennov Regulatory
IDMP
Solution de Data Management
- Gestion IDMP simplifiée
- Gain de temps et d’effort
- Amélioration de la qualité des données
- Services IDMP
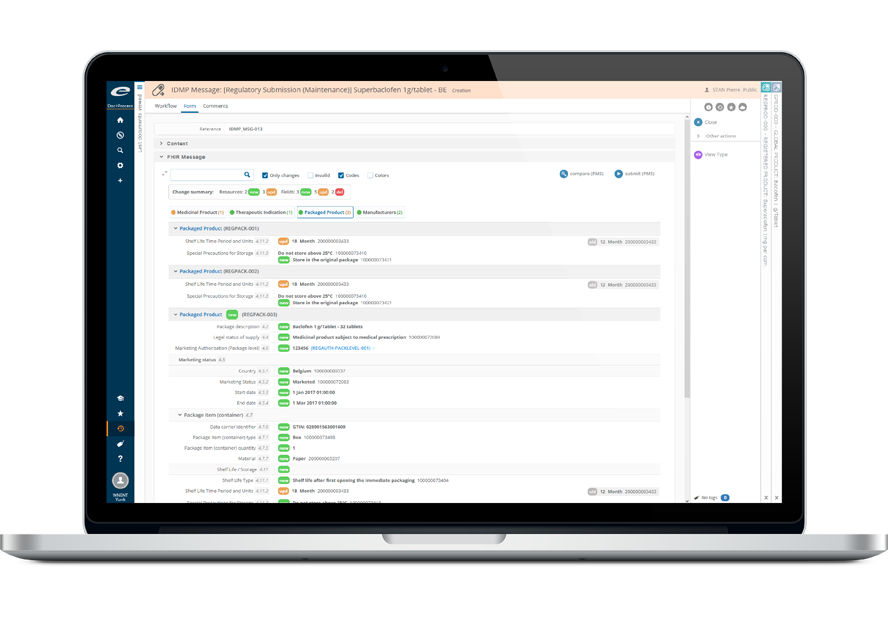
Simplifiez votre gestion IDMP
Les standards ISO IDMP (“Identification of Medicinal Products” : identification des produits médicinaux) sont une série de standards internationaux pour les éléments, les formats et la terminologie des données, utilisé pour identifier et échanger des informations ayant trait aux produits médicinaux.
L’introduction et la mise en œuvre progressive de ces nouveaux standards IDMP signifient que les organisations devront capturer et gérer significativement plus de données réglementaires qu’auparavant, ce qui représente un challenge important pour l’industrie dans son ensemble.
Une gestion des données efficaces nécessite des efforts significatifs, du temps et de l’argent. Ennov IDMP et nos services IDMP simplifient le processus de maintenance de vos données IDMP durant votre transition vers le nouveau standard.
Garantissez la qualité de vos données IDMP
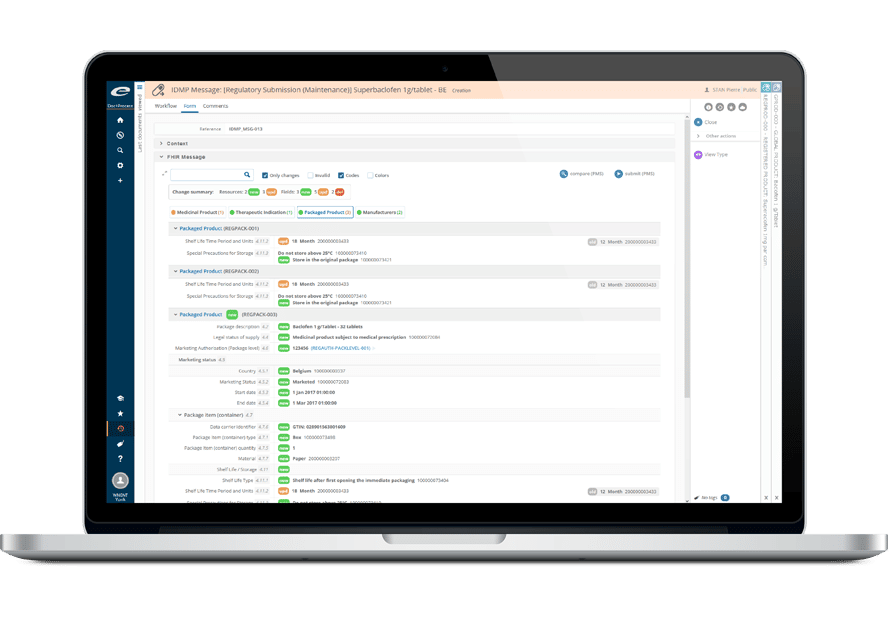
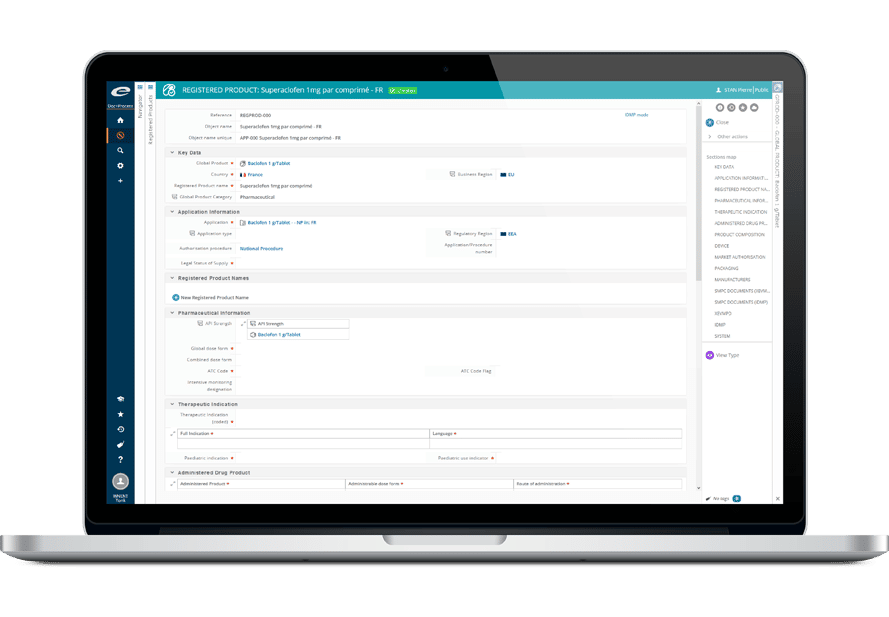
Ennov IDMP est une solution de gestion des données faisant l’objet d’un contrôle qualité, pour la prise en charge des nouveaux standards IDMP.
Prenez de l’avance sur la conformité IDMP : exploitez vos données existantes ! Inventoriez, identifiez, nettoyez et intégrez vos données, pour une organisation prête pour le changement.
Garantissez la complétude de vos données en extrayant les informations contenues dans votre documentation réglementaire et vos autres applications professionnelles.
Connectée au futur
Ennov RIM est prête pour l’IDMP. Nous prenons actuellement en charge les listes SPOR de l’EMA (listes de vocabulaire contrôlé) au sein du système et annotons chaque élément de données d’un indicateur “IDMP Term”.
À mesure qu’elles évoluent, les spécifications SPOR pour les services de données seront systématiquement incorporées dans la solution, exploitant pleinement la flexibilité et la paramétrabilité de la plateforme Ennov.
Ennov IDMP est un composant clé de notre suite complète de solutions réglementaires. Associée à Ennov Doc, Ennov RIM, Ennov Dossier, Ennov Report et à notre API REST, Ennov a aujourd’hui la solution à tous les problèmes que vous pourriez rencontrer demain.
Préparez la conformité IDMP
Chez Ennov, nous savons que la conformité avec ISO IDMP représente un défi de taille pour les entreprises, et qu’adresser ce challenge représente un poids supplémentaire sur les personnels des affaires réglementaires.
Pour aider l’industrie à répondre de façon efficace et efficiente à ce nouveau standard, Ennov propose un service d’évaluation du niveau de préparation IDMP, une première étape cruciale à la préparation aux soumissions IDMP.
Cette évaluation vous fournira une analyse documentée, identifiant les différentes sources de données (structurées et non structurées) ainsi qu’un récapitulatif des insuffisances qui devront être adressées pour garantir la conformité IDMP.
Fonctionnalités principales
- Utilisation des listes de vocabulaire contrôlé disponibles
- Aide à l'extraction, au nettoyage et à la migration des données
- Gestion pragmatique des données IDMP
- Gains de temps et d'efforts
- Amélioration de la qualité et de l'intégrité des données
Fonctionnalités clés
- Orienté métadonnées
- Hautement paramétrable
- Suivi des informations
- Intégration fluide avec la suite Ennov Regulatory
- Fonctionnalités robustes de reporting et d'analyse
Ennov Regulatory
Gestion de l’information et du contenu réglementaire de classe mondiale
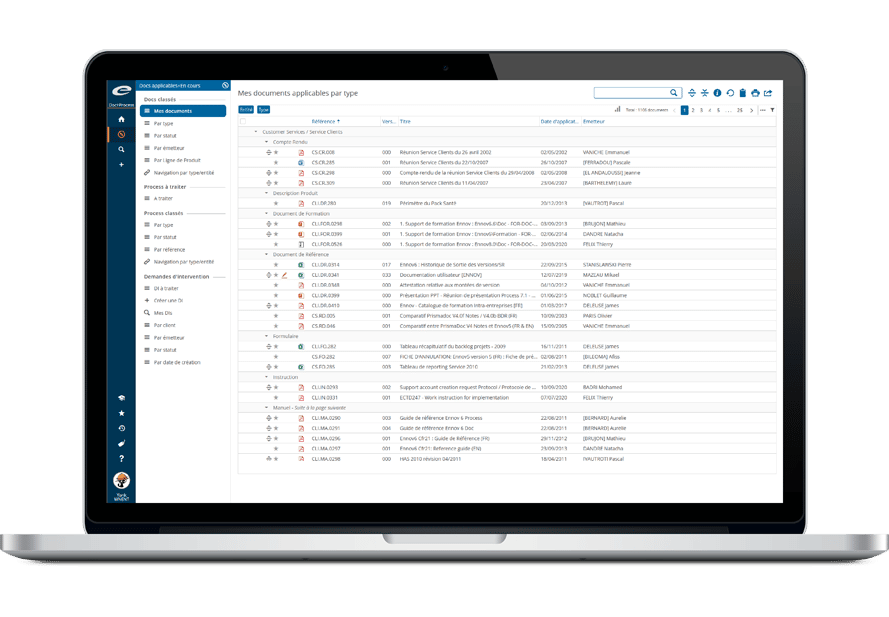
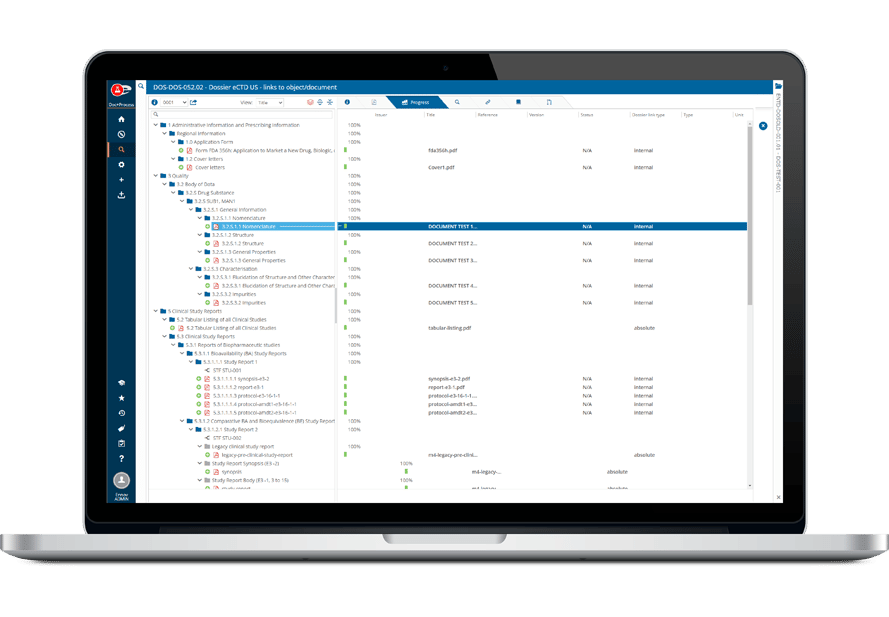
La suite Ennov Regulatory combine la puissance et la flexibilité d’Ennov Doc, Ennov Dossier et Ennov Process pour prendre en charge l’ensemble du cycle de vie réglementaire des produits, depuis la planification des objectifs d’enregistrement jusqu’au retrait du produit. La suite Ennov Regulatory est un outil précieux pour la planification des activités réglementaires, la gestion des enregistrements de produits, la création de dossiers, la gestion des dossiers et plus encore.
Pourquoi choisir Ennov ?
Des centaines de professionnels nous font confiance
20+ années d'expérience des solutions réglementaires
250+ clients dans les sciences de la vie, bien d'autres dans d'autres secteurs.
Architecture et interface modernes
100% web. Hautement évolutives. Design centré sur l'utilisateur.
Notre engagement pour votre succès
Satisfaction client très élevée. 98.5% des projets livrés dans le respect des délais et du budget.
Nous respectons votre liberté de choix
Disponible en cloud ou sur site mises deployment
Basculez à tout moment entre les deux modes.
Nous vous rendons autonomes
Ni la configuration ni la gestion du système ne nécessitent de compétences informatiques.
Sécurité améliorée et performances optimisées
Les données sont stockées localement pour une flexibilité totale. Cette architecture single-tenant minimise les interruptions.

Cloud-based or On Premises

Multi-Platform