Suite Ennov Pharmacovigilance
Suite Ennov Pharmacovigilance
Une solution de bout-en-bout de collecte, reporting et analyse de données de PV humaines et animales
La suite logicielle Ennov Pharmacovigilance
La suite de pharmacovigilance d’Ennov réunit la collecte, la gestion, l’évaluation et le reporting des événements indésirables dans une unique base de données unifiée, tout en fournissant des outils avancés de détection de signaux et d’analyses de données de PV. Notre logiciel est actuellement utilisé par des entreprises des secteurs pharmaceutiques, biologiques et des dispositifs médicaux, par des CMO, des CRO et des autorités sanitaires reconnues à travers le monde.
Avantages
- Unique source de vérité : Gérez et suivez toutes vos données de pharmacovigilance dans une seule base de données unifiée pour rationaliser les opérations de pharmacovigilance et garantir la conformité réglementaire.
- Meilleures performances : Éliminez le papier et la saisie manuelle de vos processus. Automatisez vos entrées de cas de pharmacovigilance et profitez de formidables gains de productivité.
- Conformité garantie : Ayez la certitude que tous les aspects permettant d’atteindre et de maintenir la conformité réglementaire, y compris le reporting digital, sont intégrés et respectés.
- Meilleure visibilité : Obtenez une vue d’ensemble en temps réel de votre base de données de pharmacovigilance avec indicateurs et tableaux dynamiques. Get a real-time overview of your safety database with dynamic metrics and dashboards.
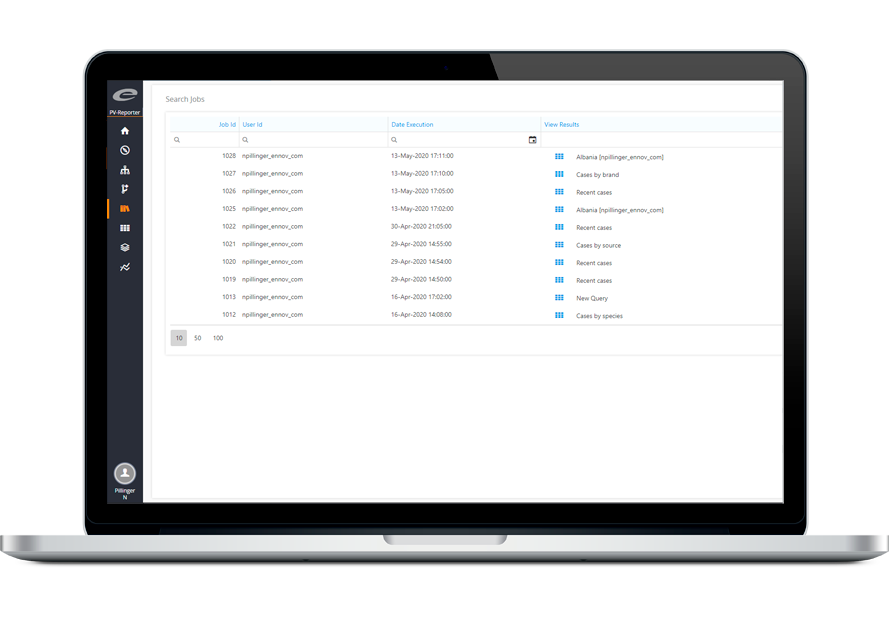
Saisie des cas et soumission aux autorités
Logiciel de pharmacovigilance pour la santé humaine et animale
Notre plateforme est utilisée par les laboratoires pharmaceutiques, les CRO et les agences de sous-traitance en pharmacovigilance pour enregistrer, signaler et analyser les événements indésirables se produisant durant les essais cliniques ou post-commercialisation.
La solution garantit la saisie efficace et précise des cas de PV et soumet de façon fluide les données de pharmacovigilance à la FDA, l’EMA ou aux autres autorités réglementaires internationales via la passerelle E2B conforme fournie. Effectuez des évaluations contrôlées ou appliquez des codages standard, tout en maintenant une totale conformité réglementaire.
Tous les formats de reporting courants de cas isolés ou agrégés sont disponibles.
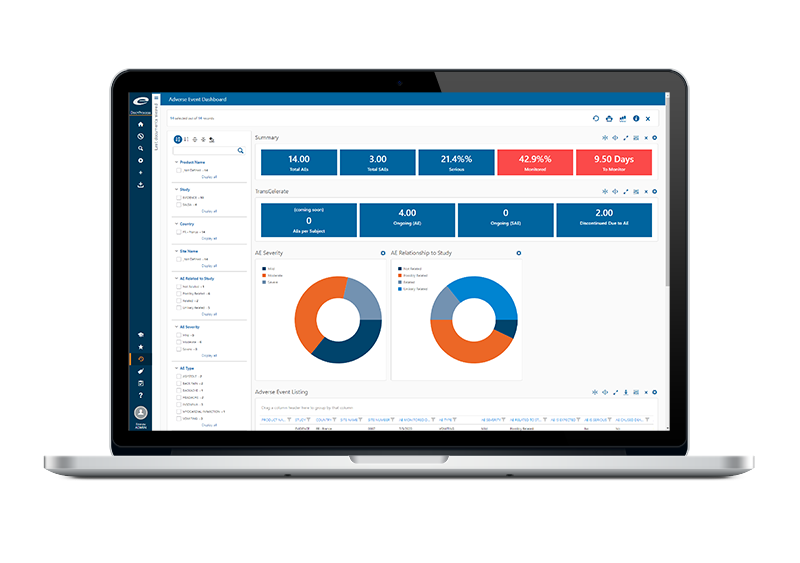
Détection et analyse de signaux
Signal Detection and Management Pharmacovigilance Analysis Software
Notre solution de détection et analyse de signaux est un repository entièrement interrogeable de l’ensemble des activités de gestion des signaux. Il permet aux utilisateurs de consulter les données et les conclusions précédentes, et d’évaluer l’évolution d’un signal donné au cours du temps. Il inclut également des workflows paramétrables, de sorte à refléter vos processus de gestion du risque.
Une fois la vérification d’un signal effectuée, un “rapport récapitulatif du signal” est automatiquement généré, documentant les circonstances d’identification du signal, ainsi que l’information récoltée tout au long du processus de son évaluation et de son analyse.

 Suite Ennov Pharmacovigilance
Suite Ennov Pharmacovigilance