Suite Ennov Clinical
eTMF, TMF Archive
Logiciel de gestion de la documentation des essais cliniques
- Logiciel eTMF complet
- Hautement configurable
- Modèle de document basé sur les métadonnées
- Recherche facile et intuitive
- Évolutive et sécurisé
eTMF
Le Trial Master File : un véritable défi
La documentation, essentielle pour les essais cliniques, est indiscutablement l’une des activités les plus prenantes et les plus coûteuses associées à leur conduite. Le texte des bonnes pratiques cliniques ICH E6 spécifie une liste de plus de 200 documents distincts devant être gérés avant, pendant et après l’essai clinique.
L’ensemble, ou chacun, de ces documents doit être disponible pour audit par le promoteur et inspection par les autorités réglementaires. Étant donné le volume massif de documentation associé au processus, une gestion documentaire efficace pourra avoir un impact significatif sur les coûts et les délais nécessaires à la finalisation de l’essai clinique.
Malgré le temps, les efforts et le budget que cela représente, le trial master file (TMF) continue souvent d’être géré via une combinaison de papier et de simples dossiers partagés, éparpillés à plusieurs endroits à travers le monde.
Prenez en main votre documentation clinique !
Avec l’eTMF, rassemblez et gérez facilement la documentation essentielle de vos essais cliniques ! Notre eTMF propose aux équipes cliniques un référentiel centralisé, accessible partout et en permanence, via Internet. Grâce à notre solution, profitez de processus rationalisés, d’une meilleure transparence, d’un suivi simplifié et d’une sécurité améliorée.
Notre eTMF met de plus à profit la puissance de son logiciel complet de GED et de son logiciel de gestion des processus métier, fondations de sa solution. Un modèle de document robuste basé sur les métadonnées, des workflows hautement paramétrables et de puissantes fonctionnalités de recherche, associées à des vues flexibles et une interface utilisateur attractive et intuitive, se combinent pour fournir toutes les fonctionnalités nécessaires à une gestion efficace et efficiente de la documentation des essais cliniques.
Un logiciel eTMF basé sur les standards, mais hautement flexible
Notre eTMF est une solution complète de gestion de la documentation des essais cliniques. Le référentiel documentaire est préconfiguré en accord avec le TMF Reference Model du DIA et inclut toutes les zones, sections et artéfacts requis.
L’eTMF propose un modèle de documents basé sur les métadonnées, offrant la flexibilité nécessaire pour s’adapter facilement aux besoins organisationnels de votre entreprise. De plus, grâce à notre suite d’utilitaires de design intuitifs, vos administrateurs configurent et gèrent facilement le système, sans aucune compétence informatique. Enfin, la capacité d’évolution et la sécurité de notre eTMF vous permettent de gérer en toute sécurité de larges volumes de documents, ce qui en fait la solution parfaite pour des déploiements globaux.
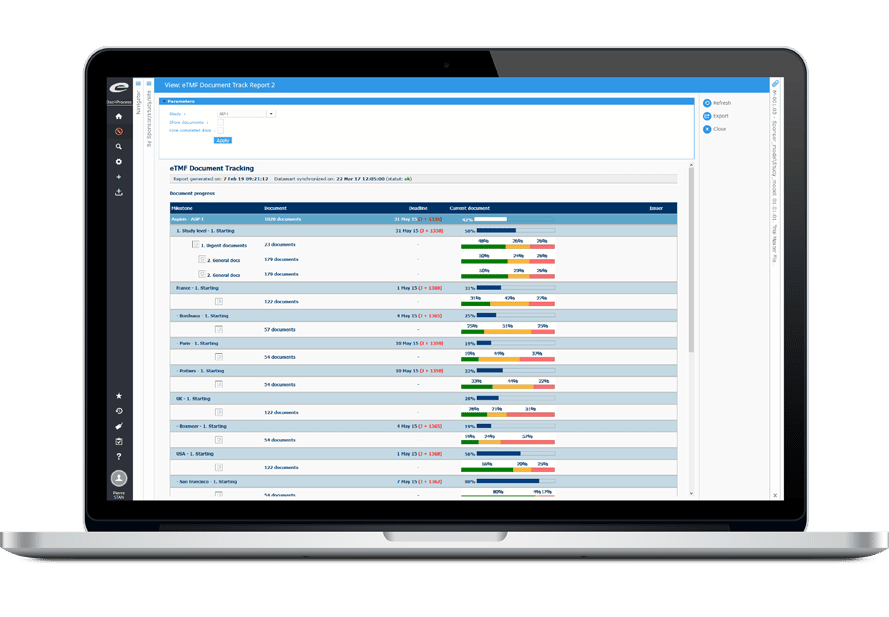
Indicateurs TMF : La clé pour maintenir la bonne santé de son TMF
Maintenir un TMF de haute qualité, prêt en cas d’inspection, peut paraître extrêmement compliqué. Trois indicateurs clés sont essentiels à la compréhension de l’état de santé d’un TMF : sa complétude, sa qualité et le respect des délais. Les tableaux de bord d’Ennov présentent ces informations dans un format facilement compréhensible. Ils permettent également l’analyse et l’investigation drill down de façon à identifier et adresser la cause profonde des problèmes. Des seuils d’indicateurs ajustables permettent également aux utilisateurs de voir d’un simple coup d’œil si les objectifs sont atteints. Avec les tableaux de bord de l’eTMF, diminuez le risque et augmentez l’efficacité et la qualité !
Fonctionnalités principales
- Référentiel documentaire préconfiguré
- Gestion sophistiquée du cycle de vie des documents
- Gestion flexible des droits utilisateurs
- Rendu PDF automatique
- Intégration scanner
- Vues et tableaux de bord de suivi préconfigurés
- Liste des documents requis
Fonctionnalités clés
- Tableaux de bord des tâches intégré
- Types de documents, workflows et vues paramétrables
- Notifications automatiques par e-mail
- Interface utilisateur intuitive
- Lecteur de PDF intégré
- Full web
- Conforme 21 CFR Part 11
TMF Archive
L'archivage du Trial Master File : un véritable défi
Un promoteur n’a pas toujours besoin d’un TMF actif. Les organisations qui sous-traitent l’ensemble de leurs essais cliniques dépendent par exemple de leur CRO partenaire pour la gestion du TMF durant l’essai. Une fois celui-ci finalisé, le CRO remet généralement le TMF au promoteur, qui est ensuite dans l’obligation de garantir la sécurité et la disponibilité du TMF sur le long terme. Cette obligation couvre souvent des périodes de 25 ans voire plus.
Dans ce cas, les besoins du promoteur sont simples, mais cruciaux. Il doit s’assurer de l’intégrité des enregistrements, en limiter l’accès aux utilisateurs autorisés, et en permettre l’inspection par les autorités sanitaires. Une solution eTMF complète pourra être excessivement chère et complexe pour ces seules fonctionnalités.
Une archive simple, inspectable
Le TMF Archive fournit un archivage sécurisé, qui permet une navigation et une recherche simples. Grâce à une arborescence des dossiers basée sur le TMF Reference Model, les inspecteurs trouvent rapidement et facilement les documents dont ils ont besoin. Ils peuvent également accéder et filtrer une liste des documents TMF, et utiliser une variété d’outils de recherche. Il est possible de mettre des documents en favori, ou d’accéder une liste des documents affichés récemment.
Vous pouvez contrôler les dossiers auxquels un inspecteur pourra accéder sur la base du périmètre de son inspection, et afficher une liste des documents auxquels il a accédé et dans quel ordre.
Des processus de migration et de validation rationalisés
Les documents sont facilement transférables dans le TMF Archive. Ce processus de migration utilise les données clés présentes dans tout TMF (étude, pays, site et type de document / d’artéfact) pour renseigner les études. Il peut également accepter et afficher des informations plus avancées, comme la date du document, la date d’expiration, le sujet, le sous-artéfact ou tout autre donnée personnalisée.
La solution étant spécifique aux besoins d’archivage TMF, la validation peut être effectuée très rapidement. Nous fournissons un pack complet de validation / acceptation utilisateur pour réduire la charge des utilisateurs, tout en garantissant une solution suffisamment robuste pour répondre à vos besoins pendant de nombreuses années.
Fonctionnalités principales
- Répertoire sécurisé
- Arborescence suivant le TMF Reference Model
- Gestion flexible des droits d'accès : limitez les accès des inspecteurs et autres utilisateurs suivant le besoin
- Navigation visuelle
- Navigation avec filtre
- Recherche avancée
- Listes des documents préférés et récents
Fonctionnalités clés
- Interface utilisateur intuitive
- Gestion facile des utilisateurs (internes et inspecteurs)
- Migration rationalisée des documents vers l'archive
- Full web
- Conforme 21 CFR Partie 11
Ennov Clinical
Une solution complète pour capturer et gérer l’information sur les essais cliniques.
La suite Ennov Clinical comprend des applications de gestion des données cliniques (EDC, RTSM et ePRO) ainsi que des applications de gestion des essais cliniques (CTMS et eTMF) qui sont disponibles pour un déploiement dans le cloud ou sur site.
Pourquoi choisir Ennov ?
Des centaines de professionnels nous font confiance
25+ années d'expérience des solutions réglementaires
450+ clients dans les sciences de la vie, bien d'autres dans d'autres secteurs.
Architecture et interface modernes
100% web. Hautement évolutives. Design centré sur l'utilisateur.
Notre engagement pour votre succès
Satisfaction client très élevée. 98.5% des projets livrés dans le respect des délais et du budget.
Nous respectons votre liberté de choix
Disponible en cloud ou sur site mises deployment
Basculez à tout moment entre les deux modes.
Nous vous rendons autonomes
Ni la configuration ni la gestion du système ne nécessitent de compétences informatiques.
Sécurité améliorée et performances optimisées
Les données sont stockées localement pour une flexibilité totale. Cette architecture single-tenant minimise les interruptions.