Suite Ennov Clinical
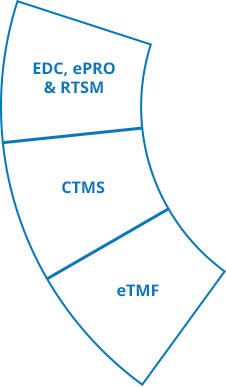
CTMS
Logiciel de gestion des essais cliniques
- Logiciel CTMS complet
- Intégré avec Ennov EDC
- Claire visibilité des sites investigateurs
- Workflow de travail intégré
- Full web
La gestion des essais cliniques : un véritable défi
Tous les ans, les entreprises des sciences de la vie recherchent de nouvelles façons d’améliorer l’efficacité des essais cliniques et d’en diminuer les coûts. Elles se heurtent ce faisant à de nombreux obstacles. Parmi ceux-ci, le plus significatif est probablement la sélection, le monitoring et la gestion efficaces des sites investigateurs.
L’efficacité opérationnelle et la productivité des sites peuvent être améliorées en menant plusieurs actions – centraliser l’information, fournir des outils de recrutement et de screening, automatiser la programmation des visites, gérer les finances – et via un reporting et des indicateurs corrects et précis. Ces défis peuvent être relevés grâce à un logiciel CTMS (“Clinical Trial Management Software” : logiciel de gestion des essais cliniques), qui sert d’unique source de vérité pour les données cliniques opérationnelles liées à la planification, à la gestion et au reporting des essais cliniques.
Une unique source de vérité pour les informations cliniques
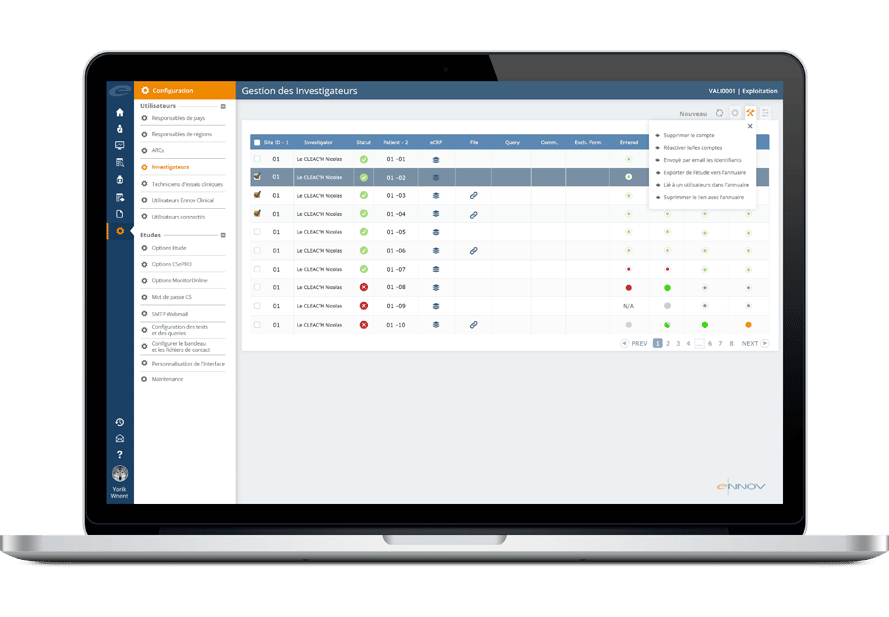
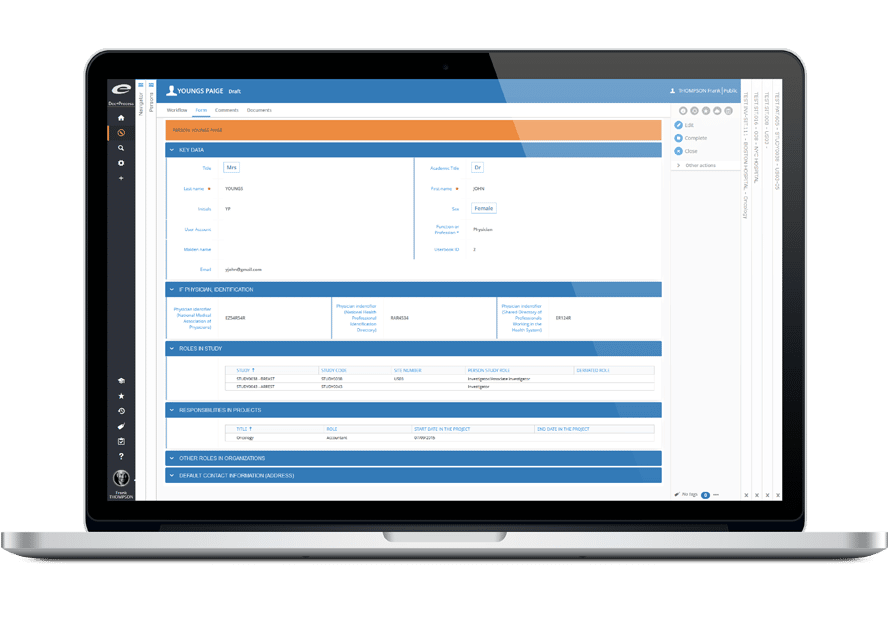
Ennov CTMS facilite la gestion de bout-en-bout des essais cliniques. Le logiciel permet aux promoteurs d’être plus efficaces, de prendre de meilleures décisions, d’assurer la conformité, de bien sélectionner les investigateurs, de monitorer le recrutement des participants et de gérer les aspects financiers. Ennov CTMS constitue un référentiel de données complet pour gérer le personnel sur site (investigateurs, sous-investigateurs, coordinateurs d’étude, pharmaciens) ainsi que les organisations (hôpitaux, autorités compétentes, CRO, fournisseurs).
Ennov CTMS fournit des fonctions de suivi des patients, des visites aux patients, des données EDC, des activités, des requêtes, des déviations, des événements indésirables, de l’approvisionnement en médicaments et des finances. Une batterie complète de rapports et de tableaux de bord apporte une visibilité totale sur le statut de chaque étude, pays, site et investigateur afin de fournir l’information nécessaire pour prendre les meilleures décisions possibles.
Un logiciel CTMS centralisé et accessible mondialement
Construite sur la plateforme de conformité Ennov (Ennov Process, Ennov Doc, Ennov Report), Ennov CTMS en exploite la puissance et la flexibilité pour fournir une solution full web centralisée, accessible aux équipes cliniques partout, à tout moment. Des règles de sécurité paramétrables contrôlent les accès utilisateurs tout en fournissant des fonctionnalités collaboratives robustes aux membres des équipes internes comme aux partenaires extérieurs.
Ennov CTMS est entièrement intégrée avec les applications de la suite Ennov Clinical. Les informations contenues dans Ennov EDC peuvent être directement importées dans Ennov CTMS, accélérant ainsi le démarrage des études et éliminant le besoin de saisie redondante des données. Cette approche, basée sur la consolidation des données des essais cliniques dans un unique référentiel, confère au chef de projet un avantage compétitif pour la prise de décision tout en améliorant la qualité et la cohérence des données.
Des analyses avancées pour la gestion des risques
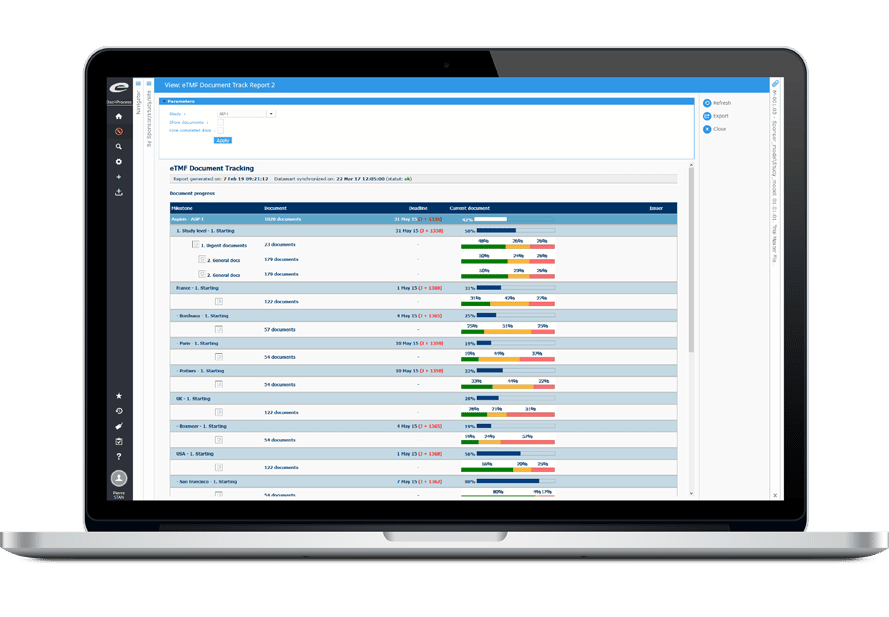
Les véritables approches basées sur le risque nécessitent des données en temps réel afin d’anticiper, de détecter et d’atténuer le risque. Ennov CTMS propose des tableaux de bord qui unifient l’information afin de présenter statuts, évolution, risques et valeurs aberrantes de façon claire.
Les tableaux de bord couvrent le recrutement / la participation, le statut des sites et des participants, les déviations de protocole et les CAPA, le statut des autorités sanitaires, les événements indésirables, les requêtes et bien plus encore. De nombreux tableaux de bord incluent des recommandations d’organisations reconnues du secteur comme TransCelerate. Les utilisateurs peuvent affiner leur analyse pour se concentrer, entre autres, sur certaines études, certains pays ou sites investigateurs, et exporter des données en un clic pour alimenter feuilles de calcul, présentations ou rapports.
Fonctionnalités principales
- Organisation et annuaire complet du personnel
- Suivi du recrutement des patients
- Suivi des requêtes et déviations
- Suivi des événements indésirables
- Suivi de l'approvisionnement en médicaments
- Suivi financier et budgétaire
- Puissantes fonctionnalités de suivi
Fonctionnalités clés
- Base de données centralisée
- Workflow intégré
- Model de données exhaustif et configurable
- Interface utilisateur intuitive
- Intégrée avec Ennov CDMS
- Full web
- Conforme 21 CFR Part 11
Ennov Clinical
Une solution complète pour capturer et gérer l’information sur les essais cliniques.
La suite Ennov Clinical comprend des applications de gestion des données cliniques (EDC, RTSM et ePRO) ainsi que des applications de gestion des essais cliniques (CTMS et eTMF) qui sont disponibles pour un déploiement dans le cloud ou sur site.
Pourquoi choisir Ennov ?
Des centaines de professionnels nous font confiance
25+ années d'expérience des solutions réglementaires
450+ clients dans les sciences de la vie, bien d'autres dans d'autres secteurs.
Architecture et interface modernes
100% web. Hautement évolutives. Design centré sur l'utilisateur.
Notre engagement pour votre succès
Satisfaction client très élevée. 98.5% des projets livrés dans le respect des délais et du budget.
Nous respectons votre liberté de choix
Disponible en cloud ou sur site mises deployment
Basculez à tout moment entre les deux modes.
Nous vous rendons autonomes
Ni la configuration ni la gestion du système ne nécessitent de compétences informatiques.
Sécurité améliorée et performances optimisées
Les données sont stockées localement pour une flexibilité totale. Cette architecture single-tenant minimise les interruptions.