Suite Ennov Pharmacvigilance
Doc pour la pharmacovigilance
Centralisez votre documentation PV dans un système unique conforme
- Gérez les rapports de cas, les RMP, le PSMF et les accords au même endroit
- Maintenez un PSMF en permanence prêt pour l’inspection, avec une attribution claire des responsabilités et une traçabilité complète
- Suivez les accords et les obligations via des workflows, des tâches et des rappels
- Réduisez le risque de non-conformité grâce à une gouvernance standardisée
- Collaborez en toute sécurité entre équipes et partenaires
- Répondez aux exigences de la FDA 21 CFR Part 11 grâce aux pistes d’audit et aux signatures électroniques
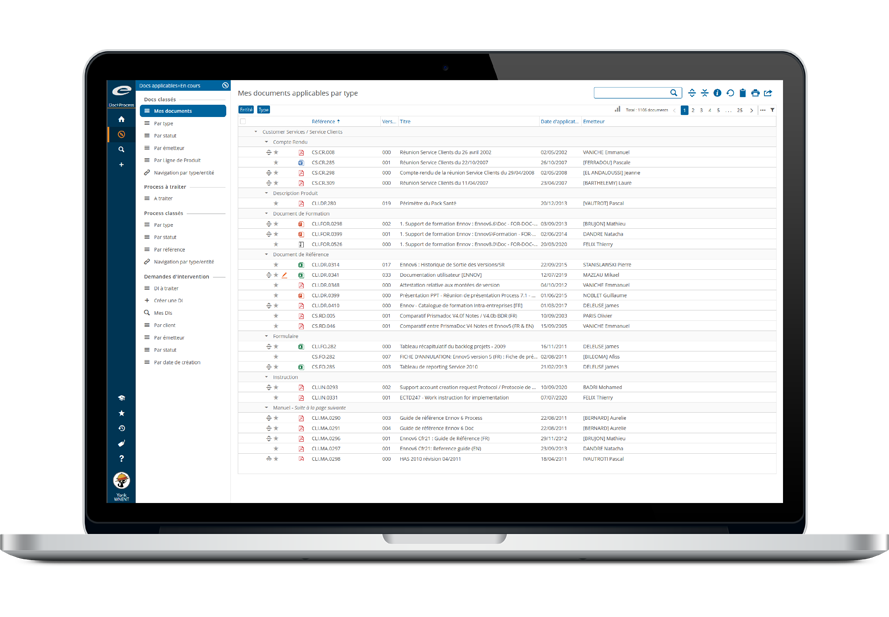
Gestion documentaire pour le PSMF, les accords et la documentation de gestion des risques
Soyez prêt pour l’inspection avec un référentiel unique conforme à la 21 CFR Part 11
Les équipes gèrent souvent le Pharmacovigilance System Master File (PSMF), les documents PV et les accords avec les partenaires à travers des lecteurs partagés, des e-mails et des outils non connectés. Cette fragmentation entraîne des confusions de version, des délais de recherche plus longs, une traçabilité limitée et des lacunes dans la supervision des obligations de sécurité, ce qui augmente le risque lors des inspections et complique le maintien d’un niveau de préparation aux audits, à la fois pour les exigences européennes et américaines.
Ennov Doc for PV centralise les documents et le PSMF, tout en prenant en charge la gestion des accords au sein d’un référentiel structuré conçu pour la conformité. Les équipes peuvent maintenir un PSMF prêt pour l’inspection, maîtriser le cycle de vie des documents et suivre les accords, les obligations et les activités associées, avec une attribution claire des responsabilités et des pistes d’audit conformes à la 21 CFR Part 11. Résultat : une documentation globale plus cohérente, une collaboration sécurisée entre équipes internes et partenaires, et moins de ruptures opérationnelles lors des audits et inspections.
Les 4 composants clés d'Ennov Doc for PV
Soumissions & rapports
Centralisez l'ensemble des soumissions et des rapports — agrégés, cliniques et de sécurité — générés depuis votre base de données de sécurité et soumis aux autorités de santé et autres organismes compétents, en parfaite conformité avec les exigences mondiales de reporting.
Gestion des risques
Gérez l'intégralité du cycle de vie des documents de gestion des risques, globaux et locaux, en vous appuyant sur les données de sécurité, les évaluations de risques et les indicateurs qualité afin de soutenir une évaluation bénéfice–risque continue et robuste.
Accords
Rationalisez la gestion des accords définissant les rôles, responsabilités, échanges de données et obligations entre partenaires, filiales/affiliés et tiers. Suivez les responsabilités grâce à la recherche avancée, aux workflows, à la gestion des tâches et aux notifications automatiques d'échéance afin d'assurer une supervision opérationnelle efficace.
Pharmacovigilance System Master File (PSMF)
Rassemblez et maintenez l'ensemble de la documentation requise au titre du GVP Module II et de la Directive 2001/83/CE / du Règlement (CE) n° 726/2004 au sein d'un classeur structuré. Générez automatiquement un PSMF prêt pour l'audit, décrivant clairement l'organisation de votre système, vos processus et votre conformité réglementaire.
Fonctionnalités principales
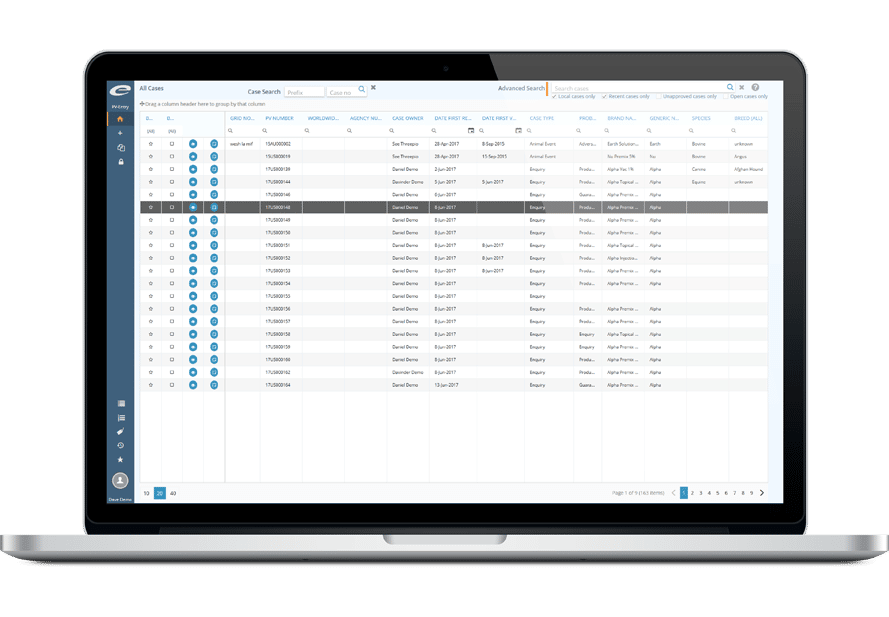
- Interface optimisée de saisie / capture des cas
- Moteur de recherche intégré
- Mise en page configurable des sections de données et des champs
- Mise en page configurable des sections de données et des champs
- Outil de codage rapide
- Palette glisser-déposer pour les données fréquemment utilisées
- Dictée vocale (speech-to-text) pour les narratifs
- Outils collaboratifs de gestion de cas (assignations/commentaires)
Fonctionnalités clés
- L'interface de saisie est configurée pour reproduire le déroulement d'un appel
- Accélère considérablement la saisie des données
- Interface moderne et intuitive
- Optimisée pour les opérations de centre d'appels
- Réduit la charge de formation et accélère l'onboarding
- Connectivité transparente avec PV-Works
- 100 % web
- Conforme à la 21 CFR Part 11
Ennov Pharmacovigilance
Une solution de bout en bout pour la collecte, le rapport et l’analyse des données de PV humaine et vétérinaire.
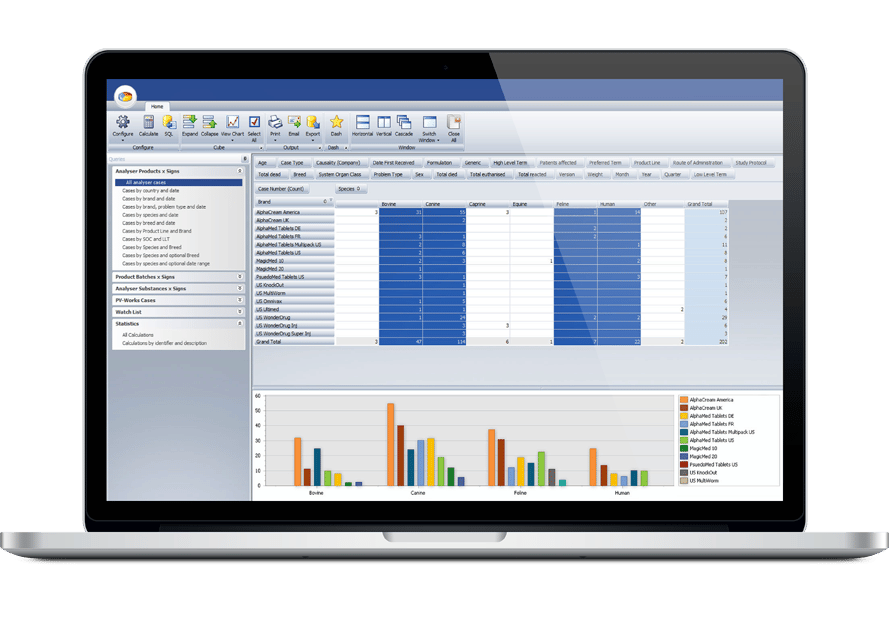
La suite Pharmacovigilance d’Ennov permet la collecte, la gestion, l’évaluation et la déclaration des événements indésirables humains ou vétérinaires dans une base de données unifiée tout en fournissant des outils avancés de détection du signal et d’analyse des données PV.
Pourquoi choisir Ennov ?
Des centaines de professionnels nous font confiance
25+ années d'expérience des solutions réglementaires
450+ clients dans les sciences de la vie, bien d'autres dans d'autres secteurs.
Architecture et interface modernes
100% web. Hautement évolutives. Design centré sur l'utilisateur.
Notre engagement pour votre succès
Satisfaction client très élevée. 98.5% des projets livrés dans le respect des délais et du budget.
Nous respectons votre liberté de choix
Disponible en cloud ou sur site mises deployment
Basculez à tout moment entre les deux modes.
Nous vous rendons autonomes
Ni la configuration ni la gestion du système ne nécessitent de compétences informatiques.
Sécurité améliorée et performances optimisées
Les données sont stockées localement pour une flexibilité totale. Cette architecture single-tenant minimise les interruptions.