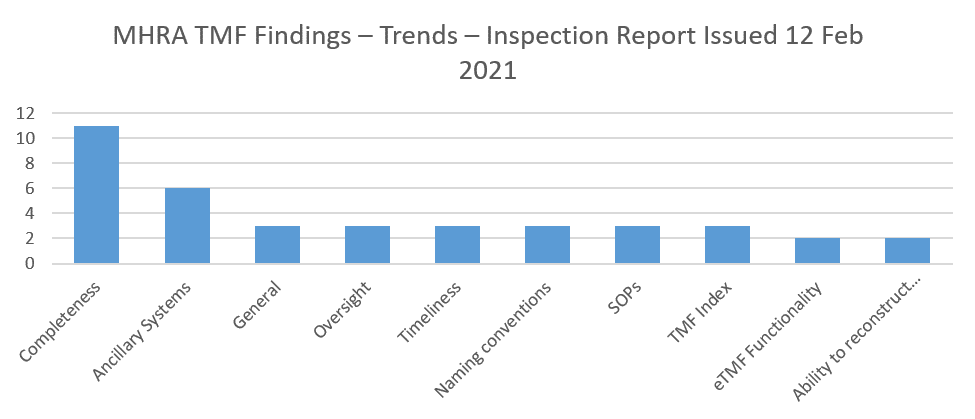
Les constatations relatives à la complétude du TMF sont les résultats d’inspection les plus couramment rapportés. Par exemple, dans le dernier rapport d’inspection des GCP publié par la MHRA, il y avait deux fois plus de conclusions dans cette catégorie que dans la catégorie suivante la plus représentée (systèmes auxiliaires).
La complétude est une donnée éphémère – elle change tous les jours pour une étude active, à mesure que des documents sont ajoutés et finalisés et que les dates limites et autres échéances changent. Cela contribue à faire de la complétude l’aspect le plus difficile de la gestion du TMF. Est-ce parce que la complétude est mal connue ou parce qu’elle n’est pas quantifiable ? Dans cet article, nous allons examiner les facteurs qui contribuent à préciser ce qu’est la complétude, et fournir quelques conseils pratiques qui vous aideront à mieux pouvoir l’évaluer.
Vous voulez en savoir plus ? Consultez notre série de webinaires : eTMF for Risk Management and Regulatory Compliance
- Episode 1: Guidance Review
- Episode 2: Completeness (en cours de lecture)
- Episode 3: Timeliness
- Episode 4: Quality
- Episode 5: Inspections
- Episode 6: Sponsor Access, Wrap-Up
L’influence des dates d’échéance
Pour comprendre le degré de complétude d’un TMF, il est nécessaire d’avoir une bonne compréhension du moment où les documents sont effectivement nécessaires. Au premier jour d’un essai, le rapport d’étude clinique n’est pas “manquant” ou “en retard” – il n’est pas encore attendu. Pour un essai en cours, la complétude doit être évaluée en fonction de ce qui est réellement attendu dans le TMF à un moment donné.
Les eTMF modernes déterminent la qualité en fonction des documents qui sont attendus à tout moment de l’essau (et pas seulement à la fin). Mais comment déterminer quand les documents sont “dûs” ?
Les dates limites peuvent provenir de nombreuses sources (pas seulement des étapes clés), comme le montre la figure ci-dessous. Pour savoir ce qui est dû à une date donnée, il faut attribuer une date d’échéance précise, et la tenir à jour au fur et à mesure de l’évolution de l’essai. Certains eTMF offrent des fonctionnalités étendues pour gérer les dates d’échéance, mais d’autres n’offrent qu’une fonctionnalité de base, voire aucune.
Sophistication des processus de planification
La plupart des eTMFs fournissent un mécanisme pour planifier l’ensemble des documents nécessaires pour un TMF. Ces mécanismes prennent souvent la forme de “placeholders”, de listes de documents attendus, de compteurs, etc. C’est l’équivalent du manifeste de l’essai ou de la feuille de calcul d’index conservés pour le TMF avant qu’il ne devienne électronique.
Le détail et la précision de ce processus de planification ont une influence majeure sur la complétude. Pour mieux comprendre, examinons quelques exemples.
Exemple 1 : Réunion de lancement
Le modèle de référence TMF comprend l’artefact et les sous-artefacts suivants pour la réunion de lancement.
| 01.04.01 Matériel de la réunion de lancement Ordre du jour, matériel de présentation et autres documents mis à la disposition des participants à la réunion de lancement de l’essai, y compris les feuilles de présence. Ordre du jour de la réunion de lancementFeuille de présence à la réunion de lancementMatériel de présentation de la réunion de lancementProcès-verbal de la réunion de lancement |
Supposons que vous ayez besoin d’un seul de chaque sous-artefact pour être complet.
L’eTMF, en fonction de sa fonctionnalité et de sa configuration, peut planifier l’un des éléments suivants :
- Planifier automatiquement un placeholder pour chaque sous-artefact, nommé avec le sous-artefact. Liste la plus précise des documents attendus.
- Planifier automatiquement quatre placeholders nommés “Matériel pour la réunion de lancement”. Donne une idée de ce qui est nécessaire, mais pas assez d’informations pour permettre aux utilisateurs de bien comprendre ce qui manque.
- Planification automatique d’un seul placeholder intitulé “Matériel pour la réunion de lancement”. Donne une image trompeuse de ce qui est nécessaire et fausse la complétude.
- Ils doivent être planifiés manuellement. Une approche qui prend manifestement beaucoup de temps et qui peut entraîner des erreurs.
Exemple 2 : Ajout d’un nouveau laboratoire en cours d’essai
Supposons qu’il soit nécessaire d’ajouter un nouveau laboratoire à un moment donné après le début de l’essai. Des documents supplémentaires devront être pris en compte pour le nouveau laboratoire. Dans ce cas, le modèle de référence TMF comporte un ensemble complet d’artefacts, chacun avec divers sous-artefacts :
Artefacts possibles (chacun avec des sous-artefacts) :
- 08.01.01 Certification ou accréditation
- 08.01.02 Documentation de la validation du laboratoire
- 08.01.03 Documentation des résultats de laboratoire
- 08.01.04 Gammes normales
- 08.01.05 Manuel
- 08.01.06 Documentation sur l’importation de fournitures
- 08.01.07 Curriculum vitae du chef d’installation
- 08.01.08 Méthodes de normalisation
- 08.02.01 Étiquette de spécimen
- 08.02.02 Dossiers d’expédition
- 08.02.03 Registre des conditions de stockage des échantillons
- 08.02.04 Documents d’importation ou d’exportation des échantillons
- 08.02.05 Registre des échantillons conservés
Là encore, l’eTMF peut mettre à jour les documents requis de plusieurs manières :
- Planifier automatiquement un placeholder pour chaque artefact et sous-artefact requis, nommé avec l’artefact/sous-artefact et le nom du laboratoire.
- Planifier automatiquement un placeholder pour chaque artefact et sous-artefact requis, nommé avec l’artefact/sous-artefact.
- Planifier un placeholder pour chaque artefact
- Ils doivent être planifiés manuellement
Il est facile de voir comment les résultats 3 et 4 entraînent un sous-dénombrement important des documents requis et l’inexactitude qui en résulte dans l’évaluation de la complétude. Le résultat 2 crée des documents planifiés mais n’indique pas clairement pour quel laboratoire ils sont nécessaires.
Documents non planifiés
De nombreux documents ne peuvent pas vraiment être planifiés à l’avance, comme le montre la figure ci-dessous :
Étant donné que ces documents ne figureront dans aucun ensemble de documents attendus ou de placeholders, des processus de gestion TMF solides sont généralement le seul moyen d’évaluer leur complétude. Là encore, l’absence de gestion de cet aspect du TMF entraînera une évaluation exagérée de la complétude qui sera souvent découverte par une autorité sanitaire lors d’une inspection.
Systèmes auxiliaires
Naturellement, tous les documents et enregistrements qui constituent le TMF ne sont pas nécessairement stockés dans l’eTMF principal. Ces enregistrements peuvent être déposés et retrouvés dans une variété de référentiels, comme indiqué ci-dessous.
Lorsque les enregistrements ne sont pas stockés dans l’eTMF principal, il faut établir les responsabilités pour garantir la complétude de leurs systèmes d’enregistrement. Les autorités sanitaires exigeront presque certainement l’accès à certains d’entre eux lors d’une inspection, de sorte que des procédures pour garantir et contrôler la complétude sont nécessaires.
Conclusion
Cet article a mis en exergue plusieurs des raisons qui rendent peu aisé le suivi de la complétude des données TMF. Toutefois, cela ne signifie pas qu’il n’est pas possible de prendre des mesures proactives pour améliorer la complétude. Voici quelques recommandations.
- Le TMF ne sera jamais parfait – concentrez-vous sur les facteurs critiques pour la qualité, les risques et l’amélioration des essais.
- Les données sont la clé. Disposer d’un ensemble complet et bien défini d’indicateurs vous permettra d’apprendre à connaître et à améliorer vos essais.
- Examinez votre outil TMF pour déceler les faiblesses de la planification. Si vous comprenez où les prévisions de complétude sont mauvaises (et pourquoi), vous pourrez peut-être réexaminer les capacités de l’outil pour en améliorer la précision. Si ce n’est pas possible, vous pouvez améliorer le processus.
- Réexaminez vos processus de capture des documents non planifiés en temps voulu pour voir s’ils peuvent être améliorés.
- Assurez-vous que vous avez établi des rôles et des responsabilités pour les documents qui ne sont pas stockés dans le TMF primaire afin d’aider à amener le TMF à un niveau acceptable de complétude.



